A punção aspirativa por agulha fina, ou PAAF da tireoide, é um dos principais métodos diagnósticos utilizados na avaliação de nódulos tireoidianos, desempenhando papel essencial na diferenciação entre lesões benignas e malignas.
Trata-se de um procedimento minimamente invasivo e seguro, que permite a obtenção de material citológico para análise microscópica. A correta indicação da PAAF baseia-se em critérios clínicos, ultrassonográficos e de risco individual, sendo fundamental para evitar cirurgias desnecessárias e direcionar o tratamento adequado.
Neste contexto, compreender quando indicar a PAAF, como realizá-la de forma precisa e como interpretar seus achados é indispensável para uma abordagem eficaz e baseada em evidências.
Indicação clínica da PAAF da tireoide: quando e por que realizar?
A indicação clínica da PAAF da tireoide é um passo fundamental no diagnóstico e manejo dos nódulos tireoidianos, visando identificar lesões malignas de forma precoce e segura.
Para isso, a decisão de realizar a PAAF baseia-se em critérios clínicos e ultrassonográficos, que auxiliem na seleção dos nódulos com maior risco de malignidade. Além disso, uma avaliação prévia detalhada, incluindo histórico clínico, exame físico e exames laboratoriais e de imagem, é essencial para garantir que o procedimento seja indicado de forma apropriada, maximizando seus benefícios e minimizando riscos e procedimentos desnecessários.
Critérios clínicos e ultrassonográficos para indicação
A indicação clínica da PAAF da tireoide é guiada principalmente pelas características ultrassonográficas dos nódulos, mais do que pelo seu tamanho isolado, uma vez que certos achados à imagem são mais preditivos de malignidade. Diversos sistemas de classificação, como o ACR-TIRADS e as diretrizes da ATA (2015), orientam essa decisão.
De maneira geral, nódulos sólidos e hipoecoicos com características suspeitas, como margens irregulares, microcalcificações, forma mais alta que larga ou calcificações periféricas, são candidatos à PAAF, especialmente se medirem entre 1 e 1,5 cm.
Já nódulos com aparência menos suspeita, como os isoecoicos ou parcialmente císticos sem sinais de alerta, indica-se biópsia apenas se atingirem 2,5 cm ou mais. Por outro lado, nódulos espongiformes e cistos puramente líquidos, por apresentarem risco muito baixo de malignidade, não requerem PAAF.
Em casos selecionados, como histórico familiar de câncer de tireoide, síndromes genéticas associadas ou exposição prévia à radiação, considera-se a PAAF para nódulos menores que 1 cm.
Portanto, a decisão de realizar a biópsia deve equilibrar o risco estimado de malignidade com a segurança do paciente, evitando procedimentos desnecessários, mas sem negligenciar potenciais neoplasias.
Avaliação pré-PAAF
Antes de indicar a PAAF da tireoide, é fundamental realizar uma avaliação clínica completa que envolve história, exame físico, dosagem do TSH sérico e ultrassonografia da tireoide. Esses passos iniciais são fundamentais para identificar fatores de risco de malignidade e selecionar os nódulos que realmente necessitam de biópsia.
História clínica e exame físico
A história clínica deve investigar elementos que elevam o risco de câncer, como:
- Crescimento rápido do nódulo.
- Exposição prévia à radiação na região cervical.
- Histórico familiar de câncer de tireoide.
- Síndromes genéticas associadas.
Já no exame físico, a presença de nódulo endurecido, fixo, linfadenopatia cervical ou paralisia de cordas vocais pode indicar possível malignidade.
Avaliação laboratorial
A avaliação laboratorial inicia-se com a dosagem do TSH sérico:
- Valores baixos sugerem possibilidade de hipertireoidismo, sendo necessário realizar uma cintilografia da tireoide. Se o nódulo for hiperfuncionante (captação aumentada na cintilografia), a probabilidade de malignidade é muito baixa e, portanto, não se recomenda a PAAF.
- Em casos de TSH normal ou elevado, a indicação da PAAF dependerá das características ultrassonográficas do nódulo.
Ultrassonografia da tireoide
A ultrassonografia da tireoide é o principal método de imagem para confirmar a presença do nódulo, avaliar suas características (como ecogenicidade, margens, presença de microcalcificações, vascularização) e identificar nódulos adicionais ou linfonodos suspeitos.
Ela também ajuda a distinguir lesões sólidas de lesões císticas e a guiar a punção de forma mais precisa, especialmente em nódulos de localização posterior ou predominantemente císticos.
Aspectos técnicos da realização da PAAF em ambiente ambulatorial
A PAAF da tireoide é um procedimento amplamente utilizado na avaliação de nódulos tireoidianos, caracterizado por sua praticidade, segurança e baixo custo. Em ambientes ambulatoriais, sua execução exige atenção a detalhes técnicos que envolvem desde a escolha adequada dos materiais até a abordagem correta do paciente e o preparo das amostras citológicas.
Equipamentos utilizados
A realização da PAAF da tireoide requer um conjunto básico de materiais, geralmente simples e de baixo custo, que garantem a segurança, eficácia e qualidade ao procedimento. A maior parte dos itens pode ser encontrada com facilidade em ambientes ambulatoriais.
Equipamentos essenciais incluem:
- Seringas plásticas descartáveis (3 a 10 mL).
- Agulhas finas descartáveis, preferencialmente de calibre 25 ou 27, com 3,8 cm de comprimento (porém, agulhas mais curtas podem ser usadas em nódulos superficiais).
- Luvas de procedimento.
- Esponjas com álcool, gaze estéril e gel estéril.
- Tampa de proteção para a sonda do ultrassom.
Além disso, utiliza-se a anestesia local com lidocaína 1% conforme a preferência do médico ou do paciente, embora não seja obrigatória.
Após a coleta, prepara-se o material obtido adequadamente para análise citológica. Para isso, utiliza-se:
- Lâminas de vidro com extremidade fosca para esfregaço do material.
- Frascos com álcool para fixação úmida imediata.
- Recipientes estéreis para coleta de líquido em nódulos císticos, se necessário.
- Formulários de identificação do paciente e local da punção, que devem acompanhar a amostra ao laboratório.
Por fim, itens adicionais para o pós-procedimento incluem cotonetes com álcool e curativos simples (por exemplo, band-aid).
Abordagens técnicas: agulha, posicionamento e preparo do paciente
Antes da punção, palpa-se cuidadosamente a tireoide e o nódulo-alvo identificado por ultrassonografia. Para isso, posiciona-se o paciente em decúbito dorsal com o pescoço hiperextendido, geralmente com um travesseiro sob os ombros para facilitar o acesso à glândula. Além disso, durante o procedimento, recomenda-se que o paciente permaneça imóvel, sem falar ou engolir.
Realiza-se o procedimento com uma seringa comum ou com o auxílio de um suporte tipo pistola (como o modelo Cameco). Insere-se a agulha no nódulo sob orientação ultrassonográfica, sendo aplicada uma leve sucção enquanto a agulha é movimentada suavemente no interior do nódulo. O uso de agulhas finas (calibre 25 ou 27) é preferido para reduzir o risco de sangramentos, especialmente em pacientes em uso de anticoagulantes.
Por fim, destaca-se que o trajeto da agulha pode ser guiado de forma paralela ou perpendicular à sonda do ultrassom, ambas as abordagens são eficazes, embora a paralela permita visualização completa da agulha.
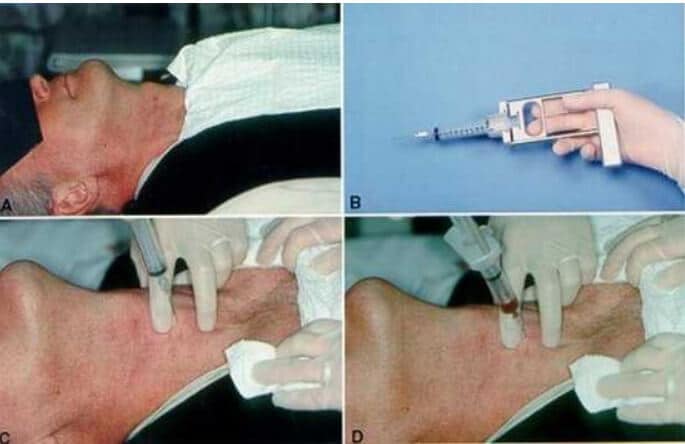
Dicas práticas para obter amostras representativas
Para garantir uma coleta eficaz, o ideal é realizar entre três e seis passagens por nódulo, principalmente quando não há um citopatologista disponível para avaliação imediata (ROSE). Sempre que possível, cada passagem deve ser feita com uma nova agulha e seringa, para garantir qualidade e segurança.
Além disso, obtém-se amostras de diferentes regiões do nódulo, especialmente das áreas periféricas, evitando-se o centro de massas maiores, onde é comum haver degeneração e conteúdo cístico. Em lesões com componente cístico, por sua vez, aspira-se o fluido totalmente, e a punção deve ser direcionada ao tecido sólido residual, caso presente.
Após a aspiração, transfere-se o material para lâminas de vidro, uma gota por vez, utilizando ar na seringa para impulsionar o conteúdo da agulha.
Leia também “Técnicas de punção aspirativa guiada por ultrassom: o que saber para prática?“
Interpretação dos achados citológicos
A interpretação da citologia da tireoide obtida por PAAF deve ser feita integrando os achados morfológicos com os dados clínicos e ultrassonográficos do paciente.
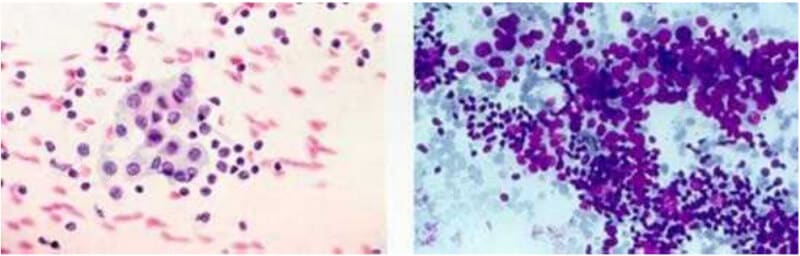
Achados benignos
Os aspirados provenientes de bócio multinodular, adenomas microfoliculares benignos ou tireoides normais classificam-se como nódulos coloides. Essas amostras apresentam agrupamentos frouxos de células foliculares, junto com coloide, sangue e, ocasionalmente, macrófagos. Os nódulos coloides representam o padrão citológico mais frequente e são caracterizados pela presença abundante de coloide e poucas células foliculares dispersas.

Já em casos como a tireoidite de Hashimoto, observa-se hipercelularidade com linfócitos e células de Hürthle, além de coloide escasso ou ausente. Enquanto a tireoidite subaguda pode apresentar células gigantes multinucleadas, histiócitos e células inflamatórias.
Achados malignos
Por outro lado, achados como núcleos irregulares com sulcos e corpos de psamoma indicam carcinoma papilar, ao passo que células fusiformes pouco coesas e presença de amiloide são características do carcinoma medular.
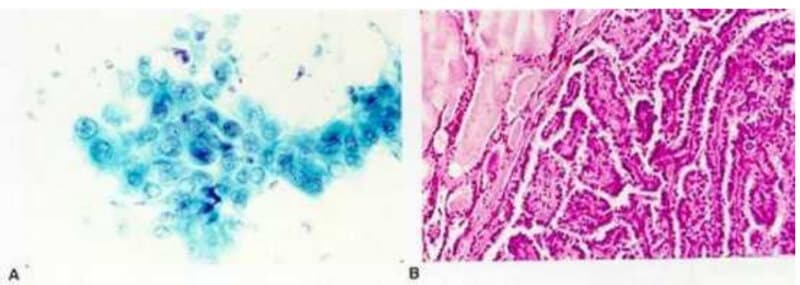
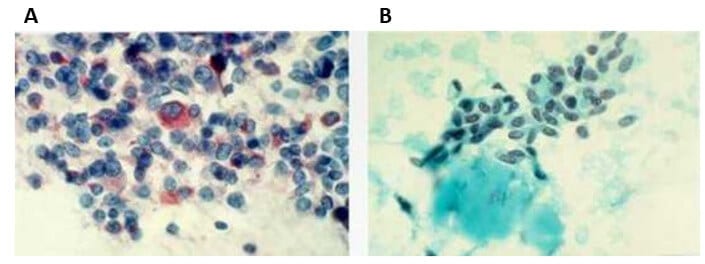
Por fim, destaca-se que a citologia maligna deve sempre ser avaliada à luz do contexto clínico, como crescimento rápido do nódulo, sintomas compressivos e histórico familiar ou pessoal de câncer, para garantir uma conduta adequada e segura.
Sistema Bethesda para tireoide: classificação e condutas
O Sistema Bethesda para relatório citopatológico da tireoide organiza os resultados da PAAF em seis categorias diagnósticas.
| Categoria | Nome | Achados citológicos comuns | Risco de malignidade | Conduta recomendada |
|---|---|---|---|---|
| I | Não diagnóstico | Amostra acelular, apenas fluido cístico, artefatos de preparação, sangue, fatores de obscurecimento | 5–10% | Repetir a PAAF |
| II | Benigno | Nódulo folicular benigno, tireoidite linfocítica crônica (Hashimoto), tireoidite granulomatosa | 0–3% | Acompanhamento clínico e ultrassonográfico |
| III | Atipia de significado indeterminado (AUS) ou lesão folicular de significado indeterminado (FLUS) | Alterações nucleares focais ou extensas, células atípicas de revestimento de cisto, microfolículos, células de Hurthle. | 6–18% (até 30%) | Repetir a PAAF, considerar teste molecular ou lobectomia diagnóstica |
| IV | Neoplasia folicular ou suspeita de neoplasia folicular | Padrão microfolicular com alterações nucleares leves, sem papilas ou pseudoinclusões | 10–40% | Teste molecular ou lobectomia diagnóstica |
| V | Suspeito de malignidade | Alterações sugestivas de carcinoma papilífero, medular, linfoma ou outra malignidade. | 45–75% | Tireoidectomia total ou lobectomia |
| VI | Maligno | Características conclusivas para malignidade: carcinoma papilar da tireoide (papilas, corpos de psamoma, pseudoinclusões); câncer medular da tireoide (pouco diferenciado); câncer anaplásico (células escamosas, metástases) | 94–99% | Tireoidectomia total ou lobectomia |
PAAF repetida ou cirurgia: quando indicar nova abordagem?
Como já demonstrado, a necessidade de repetir a PAAF ou indicar cirurgia depende principalmente da categoria citopatológica do sistema Bethesda.
Em resumo, quando o resultado é não diagnóstico (categoria I), recomenda-se repetir a PAAF, especialmente se houver suspeita clínica ou ultrassonográfica.
Já nas categorias III (AUS/FLUS) e IV (neoplasia folicular ou suspeita), a repetição da PAAF, testes moleculares ou lobectomia diagnóstica são opções, considerando o risco intermediário de malignidade.
Na categoria V (suspeita de malignidade), a conduta usual é cirurgia, dada a alta chance de câncer. Para casos malignos (categoria VI), a tireoidectomia total ou lobectomia está indicada.
A ultrassonografia complementa a PAAF, oferecendo dados fundamentais para a estratificação de risco (ex.: classificação TIRADS, presença de microcalcificações, margens irregulares, vascularização interna, crescimento do nódulo).
Além disso, mesmo em categorias Bethesda II ou III, alterações suspeitas na USG podem indicar a necessidade de nova abordagem (PAAF ou cirurgia). A evolução clínica, incluindo aumento do volume nodular, surgimento de sintomas compressivos ou linfonodomegalia, também reforça a indicação de investigação adicional ou tratamento cirúrgico.
Formação prática em PAAF: importância do treinamento supervisionado
A formação prática em PAAF da tireoide é fundamental para a acurácia diagnóstica e segurança do procedimento, e o treinamento supervisionado tem papel central nesse processo.
A curva de aprendizado influencia diretamente os resultados, uma vez que a obtenção de amostras adequadas e representativas depende da técnica correta, da identificação precisa das áreas-alvo e da familiaridade com diferentes apresentações clínicas. Profissionais em início de formação tendem a apresentar maior taxa de amostras insatisfatórias ou inconclusivas, o que pode atrasar o diagnóstico e gerar incertezas no manejo.
Nesse contexto, cursos que oferecem prática em pacientes reais, sob supervisão de especialistas experientes, são particularmente importantes, pois proporcionam vivência com diferentes tipos de lesões, domínio das nuances técnicas e desenvolvimento de confiança para atuar com autonomia e precisão.
Leia também “Erros comuns na PAAF da tireoide: Como evitá-los?“
Conheça o curso de Prática Intensiva em Biópsia de Tireoide do Cetrus
Quer dominar a técnica da punção aspirativa por agulha fina (PAAF) da tireoide com segurança e precisão? Conheça o Curso de Prática Intensiva em Biópsia de Tireoide do Cetrus!
Aqui você terá treinamento prático exclusivo, com supervisão de especialistas, vivenciando casos reais para aprimorar suas habilidades clínicas e técnicas.
Referências
- Ahmed, F. K. R.; Anawalt, B. et al. Sistema Bethesda. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK278969/table/thyroid-nod-canc-eld.T.bethesda_system_f/. Acesso em 19 jul 2025.
- Jasim, S.; Dean, D. S; Gharib, H. Fine-Needle Aspiration of the Thyroid Gland. National Library of Medicine, 2023.
- Ross, D. S. Diagnostic approach to and treatment of thyroid nodules in adults. UpToDate, 2024.
- Ross, D. S. Thyroid biopsy. UpToDate, 2024.
- Ross, D. S. Evaluation and management of thyroid nodules with indeterminate cytology in adults. UpToDate, 2024.